Cambiamenti di stato
Umidità di saturazione
Umidità relativa
Grammi di vapore necessari per saturare un ambiente ad una data temperatura
Tensione di vapore
Video molto interessante sulla pressione di vapore
|
|
Il passaggio dell’acqua dallo stato liquido a quello di vapore si chiama evaporazione, il passaggio inverso si chiama condensazione.
Le molecole dell’acqua allo stato liquido scorrono le une sulle altre; un aumento della temperatura provoca maggiore agitazione delle stesse che si manifesta con una velocità più elevata e quindi con una loro grande energia cinetica: può allora succedere che alcune molecole, vincendo la forza di coesione che le tiene unite, si stacchino dalla superficie dell’acqua ed evaporino nell'aria.
Consideriamo ora un ambiente qualsiasi, ad esempio una stanza: al suo interno sono presenti molecole d’aria, prevalentemente azoto ed ossigeno e, in misura molto minore, vapore acqueo ed anidride carbonica.
Essendo un gas, le molecole d’aria non hanno vincoli e quindi si muovono liberamente, in tutte le direzioni.
Se all’interno della stanza la temperatura è elevata, le molecole si muovono velocemente ed hanno una certa distanza tra loro; se la temperatura è minore, anche la velocità è inferiore e quindi tendono a stare un po' più vicine. Per intenderci, la velocità media può raggiungere i 500 m/sec ed oltre.
Quando parliamo di umidità dell'aria, intendiamo la presenza, tra i suoi componenti, di una percentuale più o meno elevata di vapore acqueo. Nel linguaggio comune si fa quasi sempre riferimento alla cosiddetta umidità relativa, cioè il rapporto tra la quantità effettiva di vapore contenuta nella massa d'aria, ad una determinata temperatura (umidità assoluta), e la quantità di vapore massima consentita a quella stessa temperatura (umidità di saturazione), prima che il vapore si condensi e ritorni ad essere liquido.
Il concetto
di umidità assolta è facilmente comprensibile in quanto determina la quantità di vapore, espressa in grammi, contenuta in un metro cubo di aria.
Di una spiegazione più articolata ha bisogno il concetto di umidità di saturazione.
Premessa importante: tanto più elevata è la temperatura, quanto maggiore è la quantità di vapore che l'aria può contenere.
Ed ora la spiegazione, anzi due, una più semplice ed un'altra più tecnica.
La prima: consideriamo che in una stanza, ad una certa temperatura, ci siano 100000 molecole d’aria, di cui 800 siano vapore acqueo, mentre il massimo consentito è 1000: c’è lo spazio per altre 200 molecole di vapore. Mille è l’umidità di saturazione, cioè il numero massimo di molecole di vapore che possono entrare in un ambiente a quella temperatura: oltre tale numero, le molecole di vapore non trovano spazio e quindi devono condensarsi, cioè riunirsi tra loro e formare delle goccioline.
Riassumendo: nella stanza c’è lo spazio per 1000 molecole di vapore (umidità di saturazione). Se invece che 1000, nella stanza sono presenti solo 800 molecole ( umidità assoluta, cioè quella effettivamente presente), ecco che il rapporto tra le molecole presenti e quelle di saturazione, la cosiddetta umidità relativa, è:
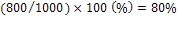
Conclusione:
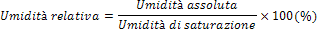
Da quanto scritto riusciamo a spiegare perché quando facciamo il bagno osserviamo due fenomeni completamente diverse, in inverno ed in estate:
in inverno la stanza, dopo poco tempo, si riempie completamente di una sorta di nebbia (“vapore “, come si dice in gergo, ma non è vapore, in quanto il vapore, essendo un gas, è invisibile: sono minuscole goccioline di acqua allo stato liquido), in estate no.
Se la quantità di vapore prodotta è la stessa, sia in inverno che in estate, non è la stessa la temperatura all’interno della stanza e quindi per saturare l'ambiente sono necessarie quantità diverse di vapore.
Chiariamo in termini numerici: alla temperatura di 10°C sono necessari 11 grammi di vapore acqueo per saturare un metro cubo di aria; alla temperatura di 20°C ne occorrono 17.3; alla temperatura di 30°C l'aria è satura quando contiene 30.4 grammi di vapore per metro cubo.
Quindi, se la temperatura all'interno della stanza, in inverno, fosse di 10°C, 11 grammi di vapore per metro cubo sarebbero sufficienti per saturare l'ambiente e produrre la caratteristica nebbia; gli stessi 11 grammi non sarebbero affatto sufficiente per saturare l'ambiente in estate, ma ne occorrerebbero molti di più (in estate niente nebbia nella stanza!).
In sostanza, in inverno l'ambiente si satura subito perché occorrono pochi grammi di vapore, in estate non avviene la stessa cosa perché ne occorrono molti di più.
..............................................................................
La seconda spiegazione: si basa su di un esperimento che è possibile descrivere in maniera solo teorica, in quanto è di difficile realizzazione pratica.
consideriamo un tubo torricelliano all'interno del quale è contenuto mercurio, disposto in maniera rovesciata come appare in figura: immettiamo alla sua base, mediante una pipetta a punta ricurva, una goccia di un liquido, ad esempio etere. 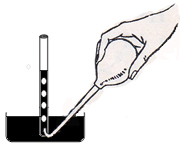
Tale goccia salirà a galla nel mercurio e si trasformarà istantaneamente in vapore. Ce ne accorgiamo per due motivi: l'uno perché la goccia, appena arriva alla superficie del mercurio scompare, l'altro perché, contemporaneamente alla scomparsa dell'etere,
si produce un abbassamento della colonna di mercurio.
Continuando ad immettere gocce di etere, notiamo sempre la loro scomparsa e il continuo abbassamento della colonna di mercurio. Ad un certo istante, però, l'etere rimane liquido sul mercurio della colonna e cessa, di conseguenza, l'abbassamento della colonna. Alla temperatura di 20° l'abbassamento provocato dalla pressione del vapore di etere è di 44 cm.
In questo istante si dice che il vapore è saturo in quanto lo spazio sovrastante il mercurio non può contenere altro vapore. Diremo quindi che un vapore è saturo quando, in uno spazio limitato, è in presenza del suo liquido.
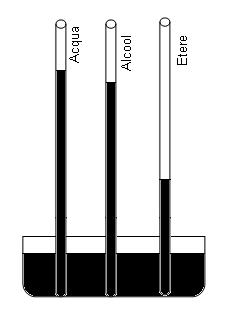
a 20° la tensione massima dell'acqua è di 1,7 cm; dell'alcool è di 4,4 cm e dell'etere è di 44 cm.
Per ulteriore chiarezza mostriamo la seguente immagine:
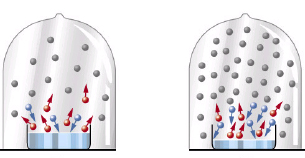
il recipiente di vetro è contenuto all'interno di una campana di vetro in cui è stato fatto il vuoto: man mano che il liquido evapora, all'interno della campana la pressione del vapore aumenta. Quando la campana è completamente occupata dal vapore, il numero di molecole che passano dallo stato liquido a quello di vapore è esattamente uguale al numero di molecole che passano dallo stato di vapore a quello liquido (basta contare le molecole rappresentate in rosso e quelle rappresentate in azzurro). La pressione del vapore non aumenta più e prende il nome di pressione o tensione di vapore.
|

